| 研究紹介 研究室の代表的な研究テーマは「Sommelet-Hauser転位」であり、この反応を利用して、温和かつ簡潔な反応条件下で特殊な構造のアミノ酸骨格を構築する研究を行っています。その他の研究テーマにも取り組んでいますが、それらは研究業績のページから雰囲気を掴んで頂ければ幸いです。このページでは代表的な内容として「Sommelet-Hauser転位」を紹介します。 ※キーワード Sommelet-Hauser転位,シグマトロピー転位,カルバニオン転位,脱芳香族転位 四級アンモニウムイリド,四級アンモニウム塩,アミノ酸 ※当研究室からの総説 有機合成化学協会誌, 2014, 72, 418-428. Chem. Rec. 2015, 789-800. DOI: 10.1002/tcr.201500009 「Sommelet-Hauser転位」の最初の報告は1930年頃ですが、制御が困難であったことから研究は進展せず、現在でもマイナー反応としての分類です。その分、当研究室の研究内容は独自かつ特徴的であり、世界中で日々発表される膨大な研究成果の中でも埋もれることがありません。国内外の化学分野研究者が最も利用している学術情報検索サイト・SciFinderで「Sommelet-Hauser rearrangement」を検索すると(2019年2月末時点)、139件がヒットし、その内の17件が当研究室から発表された論文です。著者別発表数では、1位は20件、私(Eiji Tayama)が2位の17件です。
はじめに
Sommelet-Hauser転位について
有機化学の講義では、学部2年〜3年生頃にシグマトロピー反応という内容について学習します。このシグマトロピー反応にはいくつか種類があり、Cope転位が最も良く知られている反応の一つとなりますが、その中にSommelet-Hauser (S-H) 転位という反応があります。簡単な例を示すと、ベンジル型置換基を持つ四級アンモニウム塩Aを塩基で処理してBのようなイリド(分子内にプラスの電荷とマイナスの電荷を持つ化合物のこと)を発生させると、分子内で芳香環が崩れる様に結合変換が起こり中間体としてCを生成、最後に六員環部分が芳香族化してDが生成するという反応です。
 最初の報告は1930年頃でしたが、制御が非常に困難で副反応が起こりやすいという欠点を抱えていたため、合成反応に用いられることはほとんどなく、長い間、研究が発展することはありませんでした。
研究成果
研究開始までの背景 私の研究室では一時期、[1,2] Stevens転位という反応について研究していた時期がありました。天然アミノ酸であるプロリンから四級アンモニウム塩1を合成し、続いて塩基で処理すると、窒素カチオンとエステルの間のプロトンは酸性度が非常に高いために脱プロトン化し、正電荷と負電荷が隣り合ったイリドが発生します。その後、窒素原子に付いた置換基(この場合はパラ位にブチルエステル基を持つベンジル基)が、負電荷を持った隣の炭素原子に移り、α位に四級炭素を有するプロリン誘導体2が生成します。この時、化合物1の窒素原子は、四つの異なる炭素原子が結合しているので不斉窒素原子となるのですが、原料として光学活性な化合物を使用すると、得られる生成物も光学活性体として得られ、不斉合成が可能になるという内容です。この時、水酸化セシウム(CsOH)を用い、1,2-ジクロロエタン中で反応を行うと、生成物2が最も高い光学純度で得られるという事実を見出しました。この研究は2003〜2006年まで研究室に在籍していた修士学生がまとめてくれました。
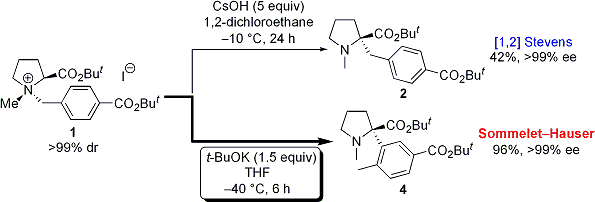
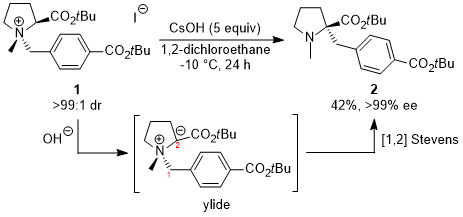 前述の学生が修士修了間近に私のところに来て、塩基としてカリウムtert-ブトキシド(tBuOK)を用いて反応を行ったところ、何かよくわからないものが得られたとNMRチャートを見せに来ました。私が見てみると、どうもS-H転位生成物であるα−アリールプロリン4らしいということがわかりました。この時は収率がまだ20%程度だったのですが、その後4月に配属してきた学部4年生に続きをやらせてみると、反応温度を下げるだけで収率が96%にまで向上し、光学純度も99%ee以上と完璧な不斉転写率でS-H転位が進行することがわかりました。ここまできれいにS-H転位が進行したということは有機合成化学的に初めての例であったことから、この結果を活かすことでα位に芳香環を有するアミノ酸の不斉合成ができるのではないかと考え、更に研究を展開していくことにしました。
 (2)非環状アミノ酸への展開,反応の不斉化,電子求引性置換基による促進効果 そこで次の展開として、グリシンのカルボキシル基部位にキラル部位として8-フェニルメントールを導入した基質5a を用いて反応を行い、ジアステレオ選択的にS-H転位を進行させることで、非天然型α-アリールグリシン誘導体6aの不斉合成を行うという計画を立てました。実際に、芳香環のパラ位にt-ブチルエステル基(CO2tBu)を導入した基質の反応を-40℃で行ったところS-H転位が収率良く進行し、ジアステレオ選択性も>98:2以上と、ほぼ完璧な結果で目的とする6aを得ることに成功しました。 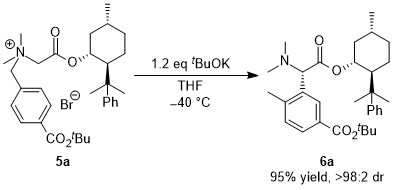 この反応は転位基の芳香環にt-ブチルエステル基以外の置換基を導入した場合にも適用可能で、更にオルト位、メタ位に置換基を導入しても同様に反応が進行します。以下にこの方法で合成できた化合物の代表例を示しますが、電子吸引性置換基を導入すると反応が促進されることがわかりました。 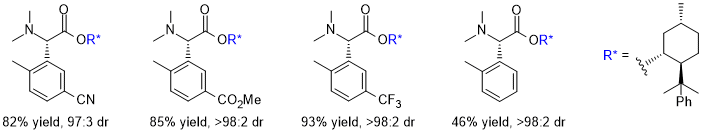 Angew. Chem. Int. Ed. 2007, 46, 8869-8871. DOI: 10.1002/anie.200703832 Org. & Biomol. Chem. 2008, 6, 3673-3680. DOI: 10.1039/b811162f (3)tBuOK THF溶液による促進効果 (2)において、塩基促進型S-H転位の新たな成功例を発表することができましたが、合成上様々な限界点が残っていました。それらを一つ一つ解決し、新たな応用へ繋げる研究を続けています。 最初の前進は、「転位基の芳香環に電子求引性置換基が無いと反応が進行しない」という問題点の解決でした。偶然にも、塩基として使用していたtBuOKですが、一般的に使われている固体試薬ではなく、THF溶液を購入して使用すると、転位基の芳香環に電子求引性置換基が無い単なるフェニル基でも、S-H転位生成物が収率良く得られ、[1,2] Stevens転位を抑えることができる知見を見出しました。 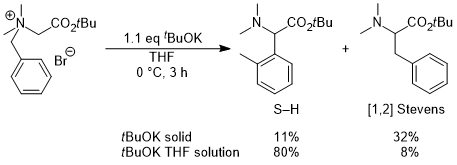 Tetrahedron 2010, 66, 9389-9395. DOI: 10.1016/j.tet.2010.09.105 (4)アミノ酸アミドによる促進効果 (3)の過程において、アミド由来の原料にすることでもS-H転位が促進され、生成物が収率良く得られる知見を見出しました。(3)の式と比較すると、同じ条件下においてS-H転位生成物の収率が向上し、[1,2] Stevens転位が抑えられていることがわかります。 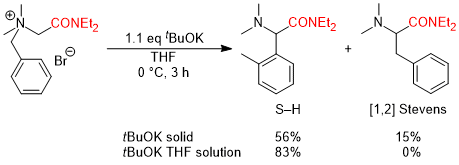 Tetrahedron 2010, 66, 9389-9395. DOI: 10.1016/j.tet.2010.09.105 (5)生成物の窒素上置換基の官能基変換:三級アミンから一級アミンへ S-H転位は四級アンモニウムイリドの反応であるため、「生成物は窒素上にアルキル基が二つある三級アミンに限られる」という合成上の欠点があります。また、三級アミンをより有用な一級アミン(-NH2)へと直接的に変換できる手法は限られています。そこで、S-H転位から生成物の一級アミンへの変換、そしてα-アミノ酸類縁体であるα-アミノアルデヒドまでの変換手法を確立しました。 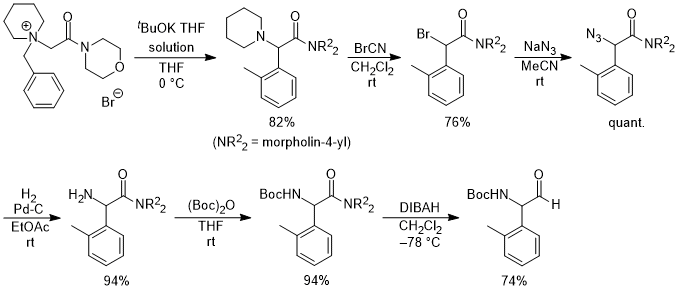 Tetrahedron 2012, 68, 4710-4718. DOI: 10.1016/j.tet.2012.04.015 (6)環ひずみよる促進効果 (1)から(4)においてS-H転位の促進条件を見出したものの、やはり反応自体の制限がかなりあり、しばらくの間、新しい知見は得られませんでした。例えば、五員環アミノ酸であるプロリンから調製した四級アンモニウム塩のS-H転位は、(3)と(4)の促進条件を用いても、S-H転位生成物は全く得られず、[1,2] Stevens転位体のみが得られました。 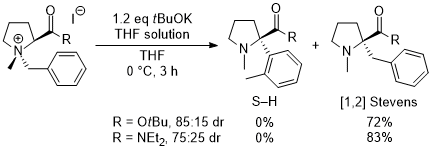 環のサイズを六員環にしてもほぼ同様の結果です。ただ(1)と(2)で示したように、この場合も「転位基への電子求引性置換基による促進効果」を利用するとS-H転位が促進され、かつ低温下で反応を行うことでS-H転位体のみを得ることができました。 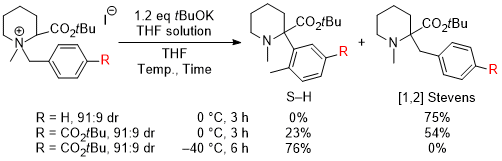 上記二つの結果は特に目新しくもなく、論文の種にもならず、しばらくの間放置していたのですが、ある時に四員環アミノ酸が容易に調製できるという論文が目に留まり、そこから環のサイズを四員環にして反応を試みることにしました。その結果、転位基に電子求引性置換基が無くとも、(3)のようにtBuOKのTHF溶液を用いなくてもS-H転位体のみが得られ、[1,2] Stevens転位が完全に抑えられるという実験結果が得られました。 原料をtBuOKで処理すると、α位の炭素上に負電荷があるイリドAと、酸素上に負電荷があるアンモニウムエノラートBとの共鳴構造となりますが、四員環によりBの二重結合形成においてひずみが発生してエネルギー的に不利となります。その結果Aの存在確率が上がり、S-H転位の初期段階である[2,3] カルボアニオン転位が進行し易くなることでS-H転位生成物のみが得られている、という結論となりました。 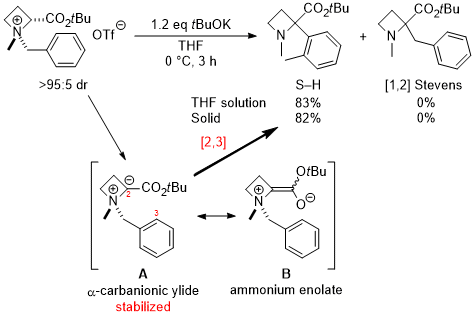 この「環ひずみによる促進効果」を利用したS-H転位を利用して、各種の特徴あるアミノ酸骨格を構築することに成功しています。※後日執筆予定 Eur. J. Org. Chem. 2016, 3631-3641. DOI: 10.1002/ejoc.201600611 Org. & Biomol. Chem. 2017, 15, 6668-6678. DOI: 10.1039/C7OB01391D (7)分子内キレートによる促進効果 研究進行中 その他・当研究室Sommelet-Hauser転位関連の研究成果 Tetrahedron: Asymmetry 2009, 20, 2600-2608. DOI: 10.1016/j.tetasy.2009.10.025 Heterocycles 2013, 87, 381-388. DOI: 10.3987/COM-12-12619 Org. & Biomol. Chem. 2018, 16, 4833-4839. DOI: 10.1039/C8OB01091A |
|
