研究紹介Research
研究概要
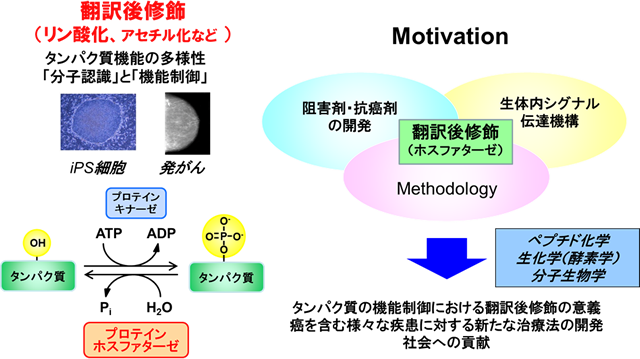
「生命」の最小単位である「細胞」は、外界からの情報を厳密に制御された細胞内情報伝達システムを介して伝達し、最終的に細胞応答としてアウトプットします。この一連の流れにおいて、中心的役割を担っているのが、「リン酸化」を含むタンパク質の翻訳後修飾であり、生体内のタンパク質はこれら翻訳後修飾によりその分子認識や機能発現、細胞内局在などが制御されています。そのため、これら翻訳後修飾に関わるタンパク質(酵素)に異常が生じると、癌を含む様々な疾患が引き起こされることが知られています。
生命現象を理解するためには、これらタンパク質の機能制御に関わる酵素の「分子認識」と「制御機構」について、分子レベルで理解することが必須です。我々の研究室では、タンパク質のリン酸化を制御する酵素、特に脱リン酸化酵素であるプロテインホスファターゼに着目し、ホスファターゼの制御異常に伴う疾患メカニズムの解明に取り組んでいます。具体的には、
テーマ①:抗癌剤を含む阻害剤開発
テーマ②:生体におけるシグナル伝達機構の解明
テーマ③:新規Methodologyの開発
の3つの柱を中心に、「化学の視点から生命現象を理解すること」を目的として研究を行っています。
研究分野
生化学、酵素化学、腫瘍診断,治療学,核酸医薬,機能生物化学、ペプチド化学
研究テーマ
テーマ①:抗癌剤を含む阻害剤開発
タンパク質は筋肉や髪の毛などの生体の構成成分要素としての働きに加え、様々な生体反応を促進させる酵素(生体触媒)として機能するものもあります。生体内において、タンパク質のリン酸化はリン酸基を付けるプロテインキナーゼと脱リン酸化を触媒するプロテインホスファターゼという2種類の酵素により厳密に制御されてます。近年ではリン酸化異常ががんを含む様々な疾患に深く関連することが知られています。
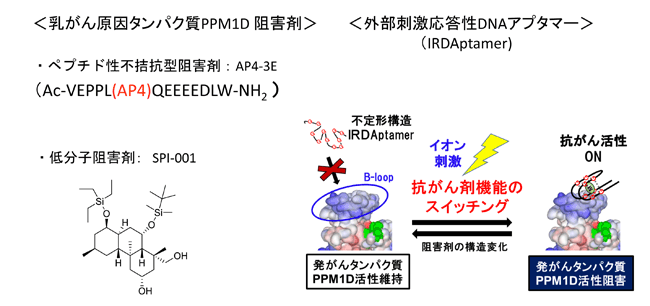
我々は、ペプチド、低分子有機化合物などを用いてPPM1Dプロテインホスファターゼを含む疾患関連タンパク質に対する特異的阻害剤の開発を行って新規Methodologyの開発います。最近では特抗体と類似の機能を有する核酸分子である「DNA・RNAアプタマー」 を用いた副作用の少ない抗がん剤開発を目指した研究を展開しています。
<関連業績>
- Kobayashi, T., Yamazaki, K., Shinada, J., Mizunuma, M., Furukawa, K., and Chuman, Y. Identification of Inhibitors of the Disease-Associated Protein Phosphatase Scp1 Using Antibody Mimetic Molecules. Int. J. Mol. Sci., 25(7), 3737, (2024) DOI: 10.3390/ijms25073737
- 特許:核酸アプタマー及びその使用,特許第7255852号,登録日R5年4月3日
- Kaneko, A., Watari, M., Mizunuma, M., Saito, H., Furukawa, K. and Chuman, Y. Development of Specific Inhibitors for Oncogenic Phosphatase PPM1D by Using Ion-Responsive DNA Aptamer Library. Catalysts, 10(10), 1153, (2020)
- Ogasawara, S., Chuman, Y., Michiba, T., Kamada, R., Imagawa, T. and Sakaguchi, K. Inhibition of protein phosphatase PPM1D enhances retinoic acid-induced differentiation in human embryonic carcinoma cell line. J. Biochem., 165(6), 471-477, (2019)
- Ogasawara, S., Kiyota, Y., Chuman, Y., Kowata, A., Yoshimura, F., Tanino, K., Kamada, R., and Sakaguchi, K. Bioorg. Med. Chem., 23(19), 6246-6249,(2015)
- Chuman, Y., Ueyama, M., Sano, S, Wu, F, Kiyota, Y., Higashi, T., Osada, S., and Sakaguchi, K. Chem. Lett., 42(8), 833-835, (2013)
- Chuman, Y., Yagi, H., Fukuda, T., Nomura, T., Matsukizono, M., Shimohigashi, Y., and Sakaguchi K. Protein Pept. Lett., 15, 938-948, (2008)
- 特許出願:細胞内分子を標的とした細胞膜透過型核酸アプタマー
出願番号:特願2019-096035 (2019) - 特許出願:発がん原因酵素を標的としたイオン応答性DNAアプタマー
出願番号:特願2019-045938 (2019)
テーマ②:生体におけるシグナル伝達機構の解明
プロテインホスファターゼは大きくSer/ThrホスファターゼとTyrホスファターゼに分類されます。生体内においてタンパク質リン酸化の多くはSer残基およびThr残基で生じているため、Ser/Thrホスファターゼのシグナル伝達の解析は極めて重要です。
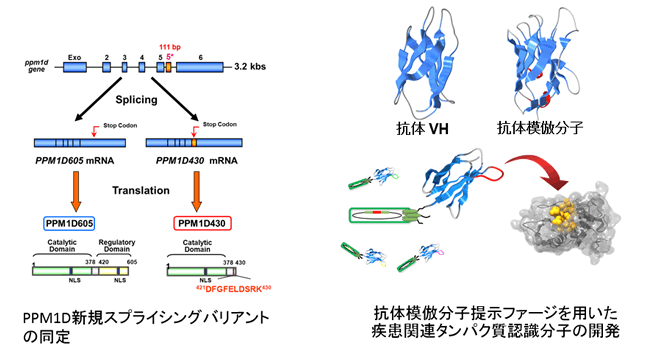
我々は、Ser/Thrホスファターゼに分類され、発がんに関与するPPM1Dホスファターゼ、ならびに神経疾患や腫瘍形成に関与するFCP/SCPホスファターゼを含む様々な疾患関連タンパク質を標的にして研究を行っています。また、抗体模倣分子を用いた基質同定やリン酸化部位認識ツールの開発も行っています。これら疾患関連タンパク質に対する新規基質同定や細胞内における機能解明を実施することにより、プロテインホスファターゼの制御破綻による疾患メカニズムの解明に取り組んでいます。
<関連論文>
- Mizunuma, M. , Kaneko, A., Imai, S., Furukawa, K. and Chuman, Y. Methods for Identification of Substrates/Inhibitors of FCP/SCP Type Protein Ser/Thr Phosphatases. Processes, 8(12), 1598, (2020)
- Uchino, R., Sugiyama, S., Katagiri, M., Chuman, Y., and Furukawa, K. Non-farnesylated B-type lamin can tether chromatin inside the nucleus and its chromatin interaction requires the Ig-fold region. Chromosoma, 126(1),125-144. (2017)
- Kozakai, K., Kamada, R., Furuta, J., Kiyota, Y., Chuman, Y., and Sakaguchi, K. PPM1D controls nucleolar formation by up-regulating phosphorylation of nucleophosmin. Sci Rep. 6, 33272. (2016)
- Xaviera, C.P., Melikova, M., Chuman, Y., Üren, A., Baljinnyam, B., Rubin, J.S. Cell. Signal., 26,94-101, (2014)
- Martin-Manso, G., Calzada, M.J., Chuman, Y., Sipes, J.M., Xavier, C.P., Wolf, V., Kuznetsova, S.A., Rubin, J.S., and Roberts, D.D. Arch. Biochem. Biophys., 509(2), 147-156, (2011)
- Chuman, Y., Kurihashi, W., Mizukami, Y., Nashimoto, T., Yagi, H., and Sakaguchi, K. J. Biochem., 145(1), 1-12, (2009)
テーマ③:新規Methodologyの開発
特許出願:核酸アプタマー組成物、抗がん剤及びがん治療キット
出願番号:特願2023-172607(2023)
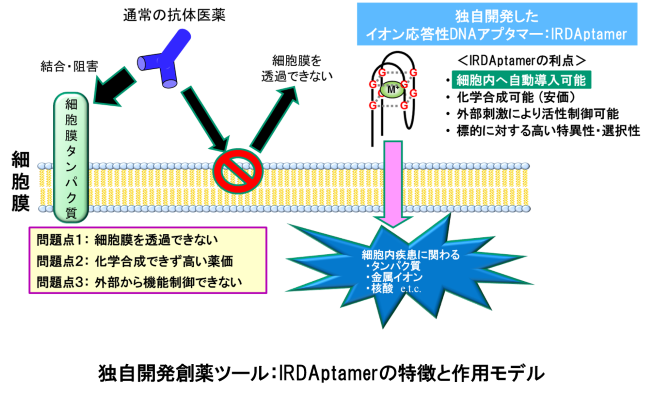
Ser/Thrホスファターゼは、生体内のリン酸化アミノ酸の大部分を占めるSer残基およびThr残基におけるリン酸化のレベル制御の中心的役割を担っていることから、Ser/Thrホスファターゼに対する(創薬開発を指向した)阻害剤・活性化剤の開発や新規基質同定法の開発が強く望まれています。
我々は、独自開発したイオン刺激応答性DNAアプタマー(IRDAptamerライブラリ)を用いて、細胞内の疾患原因タンパク質にも使用可能な高親和性・高選択性を示す「新規創薬モダリティ」の開発研究を展開しています。また、新規低分子蛍光物質や刺激応答性機能性ツールの開発、レアメタル含有バイオミネラリゼーション材料の開発研究も展開しています。
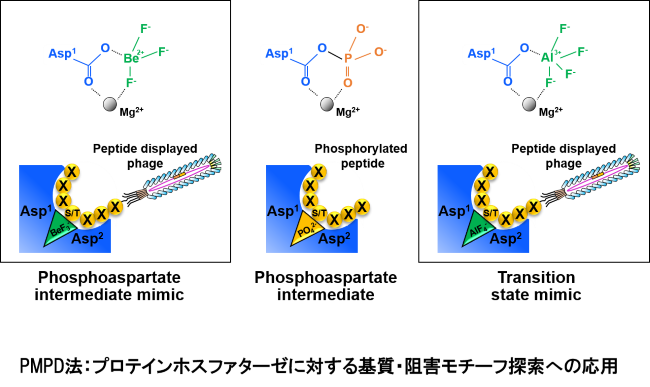
<関連論文>
- Mizunuma, M., Suzuki, M., Kobayashi, T., Hara, Y., Kaneko, A., Furukawa, K., and Chuman, Y.*. Development of Mn2+-specific Biosensor Using G-quadruplex-based DNA. Int. J. Mol. Sci., 24(14), 11556, (2023), https://doi.org/10.3390/ijms241411556
- Kaneko, A., Watari, M., Mizunuma, M., Saito, H., Furukawa, K. and Chuman, Y. Development of Specific Inhibitors for Oncogenic Phosphatase PPM1D by Using Ion-Responsive DNA Aptamer Library. Catalysts, 10(10), 1153, (2020)
- Mizunuma, M. , Kaneko, A., Imai, S., Furukawa, K. and Chuman, Y. Methods for Identification of Substrates/Inhibitors of FCP/SCP Type Protein Ser/Thr Phosphatases. Processes, 8(12), 1598, (2020)
- Yoshida, T., Yamazaki, K., Imai, S., Banno, A., Kaneko, A., Furukawa, K. and Chuman, Y. Identification of a Specific Inhibitor of Human Scp1 Phosphatase Using the Phosphorylation Mimic Phage Display Method. Catalysts, 9(10), 842, (2019)
- Otsubo, K., Yoneda, T., Kaneko, A., Yagi, S., Furukawa, K., and Chuman, Y. Development of a Substrate Identification Method for Human Scp1 Phosphatase Using Phosphorylation Mimic Phage Display. Protein Pept. Lett.. 25(1), 76-83. (2018)
- Sakai, H., Watanabe, K., Kudoh, F., Kamada, R., Chuman, Y., Sakaguchi, K. Patterning nanofibrils through the templated growth of multiple modified amyloid peptides. Sci Rep. 6, 31993. DOI: 10.1038/srep31993 (2016)
- Kamada, R., Tano F., Kudoh, F., Kimura, N., Chuman, Y., Osawa, A., Namba, K., Tanino, K., Sakaguchi, K. Effective cellular morphology analysis for differentiation processes by a fluorescent 1,3a,6a-triazapentalene derivative probe in live cells. PLOS ONE, 11(8):e0160625 (2016)
- Namba, K., Osawa, A., Nakayama, A., Mera, A., Tano, F., Chuman, Y., Sakuda, E., Taketsugu, T., Sakaguchi, K., Kitamura, N., and Tanino, K. Synthesis of Yellow and Red Fluorescent 1,3a,6a-Triazapentalene and Theoretical Investigation of Optical Properties. Chem. Sci., 6, 1083-1093, (2015)
- Chuman, Y., Iizuka, K., Honda, T., Onoue, H., Shimohigashi, Y., and Sakaguchi, K. J. Biochem., 150(3), 319–325, (2011)
